technology
rooted in cutting-edge science我々のアプローチ(Remuscularization)
iPS細胞から心筋の中でも心室筋を選択的に大量作製します。我々が独自に開発した簡便な純化精製方法(主要国で特許取得済み)で、未分化細胞及び非心筋細胞を除去し、腫瘍形成リスク、不整脈発現リスクを最小限に抑えています。
移植する再生心筋はホストの心筋に効率的に長期間生着し、心不全患者さんの心機能の長期的な改善に寄与することが期待されます。
数ある心筋再生医療に関する技術の中でも、分化心筋細胞の移植方法は治療効果を左右する極めて重要な要素です。当社が採用している心筋細胞を心筋組織内に直接注入する方法は、心筋内に直接移植された分化心筋細胞がレシピエントの心筋細胞と電気的に結合し、長期間生着することで直接収縮力を発揮する(Remuscularization)ことが期待されており、さまざまな動物実験で良好な結果を示しています。
産業化を見据えた各ステップでの独自技術
iPS細胞作製技術
これまでのiPS細胞の作製方法では患者さんの皮膚組織を採取してからリプログラミング遺伝子をゲノムに直接挿入します。しかし、この方法だとゲノムそのものに傷をつけてしまうことからガン化の可能性が否定できませんでした。当社の開発した方法では特殊なベクターを使うことでリプログラミング遺伝子をゲノムに直接挿入することなく作製できるためガン化の可能性を著しく低く抑えることに成功しました。また、わずか1滴の血液からiPS細胞を作製することが出来るため、患者さんの負担も少なくすることが出来ます。
iPS 細胞はES 細胞と同様に自己複製能と多分化能を持ちますが、細胞株によって分化能に違いがあり、ES 細胞と比べ質のばらつきがあり、iPS 細胞の質を担保することが重要です.我々は卵母細胞に特異的に発現するH1foo というリンカーヒストンタンパク質に注目し、iPS 細胞のリプログラミングの際にこの遺伝子を加えることによって、胚様体やキメラ形成の効率を高めた質の高いマウスiPS 細胞を作製することに成功しました。
分化誘導技術
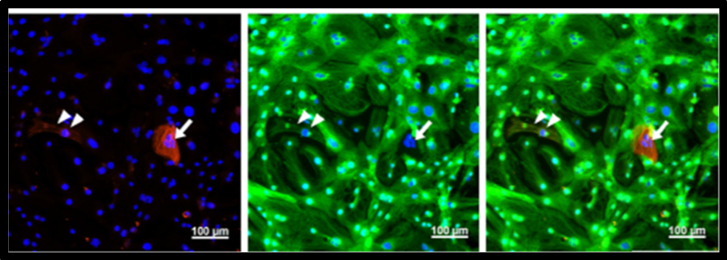
ミオシン軽鎖2a(MLC2a)とミオシンミオシン軽鎖2v(MLC2v)で免疫蛍光染色を行った。純化精製後のほとんどの心筋はMLC2v陽性の心筋細胞だった。(Tohyama S, et al. Cell Metabolism, 2016)
心筋再生医療には大量の心筋細胞が必要となってきますが、未分化なiPS細胞を心筋細胞へと分化させる上では何段階かのステップを踏む必要があります。我々も含む心臓の発生学のこれまでの多くの研究成果から、多能性幹細胞からの心筋分化誘導に関しては、心臓発生初期に関与する複数のBMP/ActivinシグナルやWnt シグナルに関連するタンパク質を組み合わせることにより、著しく分化効率を上昇できることが分かってきました。また、リコンビナントタンパク質を低分子化合物へ置換する研究も進み、より安価かつ効率よく心筋細胞を作製することが可能となりました。
一方、効率よく心筋へと分化誘導するためには、シグナルだけでなく、培養環境も重要です。我々は企業との共同研究により、すでに臨床応用可能な水準の心筋分化培養液を開発することに成功しており、低分子化合物をベースとした分化誘導法と組み合わせることで、高い心筋分化効率が得られるようになっています。また、我々の作製する心筋は、心臓のポンプ機能を担う心室筋特異的なものであることも分かっています。
大量培養技術
3次元培養により分化した細胞を塊のまま大量に作製する方法が報告されていますが、3次元培養による手法は、細胞塊が大きくなった際には腫瘍化の原因となる未分化幹細胞を完全に除去することが困難であり、その他にも細胞の増殖効率が低下する、細胞塊の大きさを均一にコントロールできない、心筋細胞への分化効率が不安定などの問題がありました。
我々は、多層培養プレートを用いた2次元大量培養系を確立しました。多層培養プレートを用いた場合には各層が均一に培養できないため、ヒトiPS細胞の増殖が不安定になることが課題でしたが、強制的に酸素や二酸化炭素を通気して各層に均一にガスを送り込む強制通気システムを活用することで、ヒトiPS 細胞の増殖が安定し、患者への移植に際して十分な大量の分化心筋細胞を得ることができました。
純化精製技術
心筋細胞への分化誘導後に未分化なiPS細胞が残存することが明らかになっており、それらの未分化な細胞が患者さんの体に移植する際に紛れ込むと腫瘍化(がん化)することが大きな問題となっておりました。そこで心筋細胞を移植する前に腫瘍化の原因となる未分化な細胞を除去し、心筋細胞のみを純化精製する必要がありました。これまではFACSというセルソーターを用いて、1つ1つの細胞を分離し、心筋細胞だけを回収する方法が主流でしたが、我々はiPS細胞と心筋細胞のエネルギー代謝を詳細に解析することにより特殊な培養液を開発し、安価かつ簡便に未分化な細胞を除去し、大量の心筋細胞を回収することに成功しました。この技術的ブレークスルーによりiPS細胞由来の心筋移植の可能性が飛躍的に高まりました。
心筋球作製技術
純化精製した心筋細胞を心臓組織に移植する際に一個一個バラバラな心筋細胞を移植しては、最終的にごくわずかな細胞数しか生着しないことを確認しており、我々はより生着率の高い移植方法を模索してきました.その結果、1,000個程度の心筋細胞を塊にした「心筋球」を作製し、それを心臓組織に移植することで、効率的に移植する方法を開発しました。この方法でiPS細胞から作った心筋細胞が心臓組織に高い割合で生着し、心筋細胞が生着後に更に成長し、実際の心機能を大幅に改善することを確認しております。弊社の社名であるHeartseedは心筋梗塞などで壊死してしまった部位に心臓の種(Heartseed)となるこの「心筋球」を移植することにちなんで命名いたしました。
さらに、心筋球を移植するための特殊な移植デバイスを開発し、術者の技術に依存することのない細胞移植システムを確立しつつあります.このような移植術者の技術的な負担を軽減し、効率よく心筋組織球の移植を行うシステムの開発は、細胞移植後の治療効果の安定性と本療法の普及に重要な役割を持つものと期待されます。
